錯イオンの立体構造って?
みなさんこんにちは!
ともきです!
勉強は早い時期からやったもん勝ち!
「今すぐ」この記事を「最後まで」読むことで、
早い時期から勉強に「差」をつけよう!
今回は「錯イオンの立体構造」について
説明していくよ!
高校化学で学ぶ錯イオンの種類はもちろん
特定の立体構造になる理由まで
徹底解説していくぞ。
この記事を全て読めば、
「入試問題で初めて知る化合物の
立体構造を推測できるようになる」
から、今すぐに読んでおこう!
立体構造のキーワード

上の写真は高校化学で登場した
錯イオンの一覧だ。
立体構造のキーワードは
・配位子の数(配位数)
・VSEPR則
の二つが「鍵」になるのを
まず初めに押さえておこう!
そして、代表的な錯イオンの立体構造は
次の写真の通りになる。

これを眺めてみると、
配位数:2個 ならば 直線形
配位数:4個 ならば 正四面体形
配位数:6個 ならば 正八面体形
のように、
配位数が立体構造に対応していると
推測できるはずだ。
この予測は正解で、
配位数が立体構造を半分決定している
といっても過言ではない。
※[Cu(NH3)4]2+だけは例外で
正方形形になるのは注意!
(化合物名:テトラアンミン銅(II)イオン)
では、残り半分の決定要因は何なのか……
それこそが VSEPR則になるんだ!
VSEPR則って何?
最初に注意しておくと、
VSEPR則は高校ではなく大学で習う
アドバンテージな内容なんだ。
それでも、この内容は非常に重要だから
知っておいて損は無いぞ!
VSEPR則とは、原子価殻電子対反発
(valence-shell electron-pair repulsion)
の略称なんだけど、
名前の由来なんて覚えなくてOK!
大事なのはその内容で、
「電子反発が小さくなる
立体配置になろうとする」
考え方がVSEPR則なんだ!
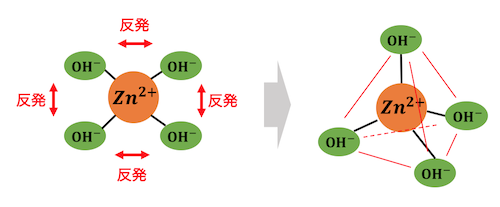
テトラヒドロキソ亜鉛(II)酸イオン:[Zn(OH)4]2-
を例に挙げて説明すると、
配位子である4つのヒドロキシ基同士が
余った価電子によって反発している。
その反発を抑えるためには
配位子同士の距離をとにかく離せばよく、
最も離れる立体配置こそが
正四面体形になるんだ!
異なる配位数も同様に
VSEPR則を適用すると、
2個ならば直線形、6個ならば正八面体形
の立体配置をとるぞ!
銅イオンの「謎」
立体構造の法則が理解できたところで
ここで一つの疑問が生じる。
「どうして[Cu(NH3)4]2+
は正方形形なのだろうか?」

さらに「テトラヒドロキシアルミン(III)酸イオン
:[Al(OH)4]-」についても同様に、
なぜか正方形形になるんだ。
次回の記事では、
それら例外の「謎」
を解き明かしていくよ!
本日はここまで!
一読ありがとうございました!
中和滴定の「あの曲線」の謎
みなさんこんにちは!
ともきです!
勉強は早い時期からやったもん勝ち!
「今すぐ」この記事を「最後まで」読むことで、
早い時期から勉強に「差」をつけよう!
本題へ移る前に軽く復習しよう。
化学基礎や化学で学んだ「中和滴定」
中和滴定で重要なのは、
水素イオン濃度([H+])なんだ。
これを表す代表的な指標として
pHがあるのも学校で学んだはずだ。
pHを数式で表すと、
pH=-log10[H+]
の形になるんだったね。
酸・塩基の滴下量を横軸に
pHを縦軸にして、
その関係を表現した曲線を
滴定曲線というんだ。

復習はここまでにして本題へ移ろう。
滴定曲線が水素イオンと水酸化物イオンが
同じ濃度になった中和点付近では、
pHが急激に変化している。
これをpHジャンプというが、
どうしてこれが起きるのか?
今回はこの謎を解き明かすよ!
塩酸を水酸化ナトリウム水溶液で
中和滴定する際の水素イオン濃度は
直線的に減少していく。

水素イオン濃度が0になる所が中和点。
しか~し!
実際は水素イオン濃度はゼロにならない!
水は、塩酸とは違って
"ほんの少しだけ"水素イオン([H+])と
水酸化物イオン([OH-])
に電離する化合物だ。
だからこそ、中和点を超えても
"ほんの少しだけ"水素イオンが
残ってしまうんだ!
純粋な水の電離では、
25℃で、[H+]=1.0×10^(-7) [mol/L]
だけ残ってしまう。

さて、pHとは対数関数であった。
水素イオンが0.1mol/Lに減るまでと
0.1mol/Lから10^(-7)mol/L
に減るまでに必要な
NaOHの滴定量をそれぞれ考えよう!
具体的な数値を求める必要はない。
大事なのは変化量!
前者よりも後者の方が
必要なNaOHが少ないのはグラフから明らか。
すなわち、少ない滴定量で
水素イオン濃度は
数桁分だけ一気に小さくなる!
非常に微量なNaOHで
桁が一気に小さくなるからこそ、
中和点付近でpHが急激に変化する!

これが
pHジャンプのメカニズム!
もしも説明が理解出来なかったら
このブログを何度も熟読したり、
数学の対数関数を復習して
完璧にマスターしよう!
本日はここまで!
一読ありがとうございました!
覚えておきたい錯イオン
みなさんこんにちは!
ともきです!
勉強は早い時期からやったもん勝ち!
「今すぐ」この記事を「最後まで」読むことで、
早い時期から勉強に「差」をつけよう!
突然ですが質問です。
「錯イオン」って
化学で習いましたよね?
「聞いたことあるよ~ん」と答える人が
ほとんどなのは明白なので
追加で質問します。
「錯イオンのイオン名
何個言えますか?」

数個しか答えられない受験生が
ほとんどでしょう。
確かに、命名法が複雑で
覚えにくいのも納得できます。
実は、錯イオンの単元は
二次試験に頻出なんです!
例えば、誰でも解ける試験問題を
大学教授が作成したとします。
そんな問題では100%合格してしまい
優秀な生徒を判別できません。
逆に難しすぎる問題でも、
点数に差は開かないため
受験の意味をなしません。
そのため大学側は
「受験生が見落としがちな部分」
を優先的に問題に取り入れることで、
受験生を選抜しているのです。

裏を返せば
「見落としポイントを
おさえれば受験で差がつく!」
まさに錯イオンは見落としポイント!
受験で大事な部分は、早い時期に
覚えた方がいいのは当たり前!
では、早速学んでいこう!
はじめに、
代表的な錯イオンを5つ挙げる。
[Ag(NH3)2]+ ジアンミン銀(I)イオン
[Cu(NH3)4]2+ テトラアンミン銅(II)イオン
[Zn(NH3)4]2+ テトラアンミン亜鉛(II)イオン
[Fe(CN)6]4- ヘキサシアニド鉄(II)酸イオン
[Fe(CN)6]3- ヘキサシアニド鉄(III)酸イオン

ここで重要なのは
錯イオンを覚えるとき、
金属イオンと配位子を分けて考えるべし!
名称をそのまま暗記はNG!
(※配位子とは
金属イオンに配位結合する
分子や陰イオンのこと)
なぜなら、丸暗記だけでは
錯イオンの命名法を問うといった
応用問題に対応できないからだ!

今回はここまで!
次回は命名法や立体構造など
本格的な内容を学んでいくよ!
ライバルに差をつけるために、
今すぐ錯イオンをマスターしちゃおう!
一読ありがとうございました!
おすすめの勉強スポット3選
皆さんこんにちは!
受験勉強進んでいますか?
「家だと気が散ってしまう…」
そんな高校生が多くいるはずです…

自分の部屋を見回してみると、
テレビ、スマートフォン、パソコンなど
誘惑の種が大量にあるはずです…
そんな環境で勉強しようとしても
「集中できずにすぐに飽きてしまう」
のは自然な流れ!
外に出て気分転換しつつ
邪魔物が全く無い環境で勉強すれば
作業が捗る(はかどる)のは明らか!
そこで今回は、
勉強に専念しやすい
おすすめスポット
を紹介してみるぞ!
*図書館の自習室
一つ目は図書館の自習室だ!
これは既に利用している高校生が
多いかもしれない。

✓静かな環境
✓受験生同士の連帯感が生まれる
✓長い時間滞在できる
これらが図書館ならではのメリットになる!
*郊外のカフェ・喫茶店
二つ目は郊外のカフェ・喫茶店だ!
「郊外の」のワードが重要だぞ!
では、どうして都心部は
オススメしないのだろうか?

✓騒音がうるさい
✓混んでで集中できない
✓2時間程度までしか滞在できない
と数多くのデメリットがあるからだ!
郊外や田舎の店を利用すると、
落ち着いて勉強できるだけではなく
コーヒーなどでカフェイン摂取が
いつでも摂れるからオススメだ!
*通っている高校
実は普段通っている高校が
環境が整ってる場合が多いんだ!

静かな環境なのはもちろん、
✓友達との遭遇率が高い
✓購買でバランスの良い食事が摂れる
✓先生から色々教えてもらえる
など、学校独自のメリットが多い!
これらの勉強スポットをフル活用して
第一志望校合格の可能性を
少しでも高めよう!
本日はここまで!
一読ありがとうございました。
『一瞬で』アルカリ土類金属元素覚えちゃおう!
皆さんこんにちは!
受験勉強は進んでますか?
今回は、
アルカリ土類金属元素
を一瞬で覚えちゃう方法を
公開しちゃうよ!
まず、アルカリ土類金属元素とは
ベリリウム(Be)
マグネシウム(Mg)以外の
二族に属する元素のこと。

その種類として、
カルシウム(Ca)
ストロンチウム(Sr)
バリウム(Ba)
ラジウム(Ra)
の4種類が存在するんだ!
最外核電子数は全て2であるので
2価の陽イオンをとり、
アルカリ金属元素よりも
単体の融点が高くなる。
アルカリ土類金属元素とそれに属さない
性質の違いも覚えておこう!
主な性質の違いを具体的に並べると、
✓単体は常温の水と反応しない
✓水酸化物は水に溶けにくい
✓硫酸塩は水に溶けやすい
✓炎色反応を示さない
が挙げられるんだ!

では、本題の方に話題を変えるよ。
アルカリ土類金属元素の覚え方は、
ズバリ! 語呂合わせ
を使うのが効果的なんだ。
受験に頻出だから
一緒に覚えていないといけない!
「ベッ(Be)トに潜り(Mg)、
彼(Ca)とする(Sr)
バ(Ba)ラ(Ra)色」

「ベットに潜り、彼とするバラ色」
「ベットに潜り、彼とするバラ色…」
これで確実に覚えられるぞ!
刺激強めな語呂合わせだけど
むしろその方が高校生には
覚えやすいんだ!
今回はここまで!
一読ありがとうございました!
『数式で分かる!』硫化物沈殿の生成条件!
皆さんこんにちは ともきです!
以前のブログでは
「溶解度積」の考え方を学んだぞ!

それを利用して、今回は
✓硫化物沈殿の生成条件
について徹底考察していくぞ!
ちなみに溶解度積が変化する条件は
✓イオン濃度が変化したとき
✓温度変化したとき
の二つに限られるのは覚えておこう!
今回は、
温度を25℃に固定した場合で
考察していくよ!
はじめに、硫化水素の電離平衡
H2S ↔ 2H+ + S2-
の平衡定数をKsとする。
ちなみにKsの具体的な値は
Ks=[H+][S2-]/[H2S]
=1.2×10^(-21) (mol/L)^2
になるんだ。

二価の金属イオンM2+と
硫化物イオンS2-との反応
M2+ + S2- → MS↓
を今回は考えてみるよ!
溶解度積をKspとして、
溶解度積の考え方を踏まえると
[M2+][S2-]≧Kspならば
沈殿が生成するんだったね!
[S2-]=Ks[H2S]/[H+]^2 を代入して
Ks[M2+][H2S]/[H+]^2≧Ksp
に変形できる。
さらにゴニョゴニョ計算すれば…
1/2×log10(Ksp/(Ks[M2+][H2S]))≦pH
の形に変形できる!
ここで重要なのは
上記の式を覚えることではなくて、
✓溶解度積が大きいほど
沈殿生成するpHが大きくなる
ことなんだ!

これを読むだけで
一部の金属元素が酸性条件下で
硫化物沈殿を生成しない
教科書の謎が解決するぞ!
今回はここまで!
一読ありがとうございました!
「溶解度積」って何だっけ?
高校生の皆さんこんにちは!
受験勉強してますか?
化学を勉強してる皆さんは、
硫化物沈澱を覚えていますか?

実は!
硫化物沈澱の生成条件は
入試に頻出な部分!
そこを「何となく」のままにすると
大事な入試本番でつまずく
危険性大!
今回は、
硫化物沈澱が生成するpHを
整理していくよ!
これを理解するには始めに
「溶解度積」という考え方を
知らなければいけない。
溶解度積とは、簡単に言うと
溶液中の陽イオン
&陰イオンの積
のこと

硫化水素を例に挙げると
水溶液中の電離反応は
H2S → H+ + S2-
すなわち [H+]^2[S2-] が
陽イオンと陰イオンの積になり
溶解度積となるわけだ
水素イオン&水酸化物イオンは
微量だから
細かく考える必要nothing!
また、溶け始める時の値をKspとすれば、
[H+]^2[S2-]>Ksp 沈澱ができる
[H+]^2[S2-]=Ksp 沈澱ができ始める
[H+]^2[S2-]<Ksp 沈澱ができない
関係が得られるのも覚えよう!
今回はここまで!
続きは次回のブログで!
一読ありがとうございました!