錯イオンの立体構造って?
みなさんこんにちは!
ともきです!
勉強は早い時期からやったもん勝ち!
「今すぐ」この記事を「最後まで」読むことで、
早い時期から勉強に「差」をつけよう!
今回は「錯イオンの立体構造」について
説明していくよ!
高校化学で学ぶ錯イオンの種類はもちろん
特定の立体構造になる理由まで
徹底解説していくぞ。
この記事を全て読めば、
「入試問題で初めて知る化合物の
立体構造を推測できるようになる」
から、今すぐに読んでおこう!
立体構造のキーワード

上の写真は高校化学で登場した
錯イオンの一覧だ。
立体構造のキーワードは
・配位子の数(配位数)
・VSEPR則
の二つが「鍵」になるのを
まず初めに押さえておこう!
そして、代表的な錯イオンの立体構造は
次の写真の通りになる。

これを眺めてみると、
配位数:2個 ならば 直線形
配位数:4個 ならば 正四面体形
配位数:6個 ならば 正八面体形
のように、
配位数が立体構造に対応していると
推測できるはずだ。
この予測は正解で、
配位数が立体構造を半分決定している
といっても過言ではない。
※[Cu(NH3)4]2+だけは例外で
正方形形になるのは注意!
(化合物名:テトラアンミン銅(II)イオン)
では、残り半分の決定要因は何なのか……
それこそが VSEPR則になるんだ!
VSEPR則って何?
最初に注意しておくと、
VSEPR則は高校ではなく大学で習う
アドバンテージな内容なんだ。
それでも、この内容は非常に重要だから
知っておいて損は無いぞ!
VSEPR則とは、原子価殻電子対反発
(valence-shell electron-pair repulsion)
の略称なんだけど、
名前の由来なんて覚えなくてOK!
大事なのはその内容で、
「電子反発が小さくなる
立体配置になろうとする」
考え方がVSEPR則なんだ!
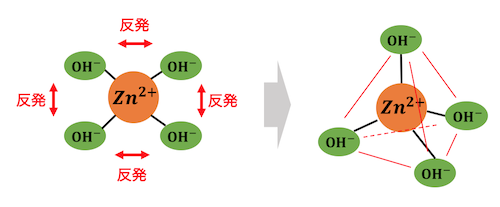
テトラヒドロキソ亜鉛(II)酸イオン:[Zn(OH)4]2-
を例に挙げて説明すると、
配位子である4つのヒドロキシ基同士が
余った価電子によって反発している。
その反発を抑えるためには
配位子同士の距離をとにかく離せばよく、
最も離れる立体配置こそが
正四面体形になるんだ!
異なる配位数も同様に
VSEPR則を適用すると、
2個ならば直線形、6個ならば正八面体形
の立体配置をとるぞ!
銅イオンの「謎」
立体構造の法則が理解できたところで
ここで一つの疑問が生じる。
「どうして[Cu(NH3)4]2+
は正方形形なのだろうか?」

さらに「テトラヒドロキシアルミン(III)酸イオン
:[Al(OH)4]-」についても同様に、
なぜか正方形形になるんだ。
次回の記事では、
それら例外の「謎」
を解き明かしていくよ!
本日はここまで!
一読ありがとうございました!