銅の錯体ってどうして正方形なの?
みなさんこんにちは!
ともきです!
勉強は早い時期からやったもん勝ち!
「今すぐ」この記事を「最後まで」読むことで、
早い時期から勉強に「差」をつけよう!
さて以前の記事について、
錯イオンの立体構造には
配位子の数&VSEPR則
の二つが関わっていることを学んだ。
配位数:2個 ならば 直線形
配位数:4個 ならば 正四面体形
配位数:6個 ならば 正八面体形
になるんだったね!
しか~し! 例外が存在する!
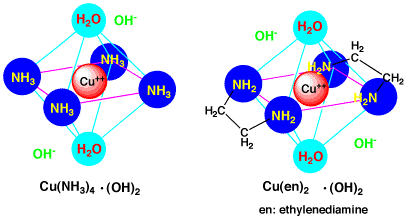
テトラアンミン銅(II)イオン:[Cu(NH3)4]2+
テトラヒドロキシアルミン(III)酸イオン:[Al(OH)4]-
は配位子が4つしかないのに
正方形形になるんだ!

今回はこの「謎」を解き明かしていくよ。
銅イオンの「謎」
あらかじめ注意しておくと、
テトラアンミン銅(II)イオンでは
高校化学の範囲を大幅に超えた
大学で学ぶ高度な知識が必要なんだ。
今回は高校生でも理解できるように
かみ砕いて説明していくよ~
一言に要約して説明すると、ズバリ!
「本当は6配位の錯体なんだけど
ヤーンテラー効果で形が歪んで
正方形のように見える」

初めて聞く単語が登場したはずだ。
まず「ヤーンテラー効果」とは何だろうか?
ヤーンテラー効果とは、
「エネルギーを安定化しようとして
分子の立体構造が変化すること」
を意味する化学用語だ!
この場合は、
正四面体形や八面体形ではなくて、
正方形形がエネルギー的に安定である
ことがいえるね!
今度は配位数に着目してみよう。
水分子は極性分子であるから、
酸素原子は負に
水素原子は正に帯電している。

すなわちイオンに近い状態なので、
さらに水分子が二つ結合するのは容易で
実際は「[Cu(NH3)4(H2O)2]2+」
の6配位で存在している。
4配位ではなく6配位になる理由はこれだ。
これ以上の詳細な説明は、
d電子だったり、縮退の解消だったりと
高校では理解し難い概念が多数登場するので
省きます! すみません!
それではお粗末なブログになっちゃうので、
ヤーンテラー効果が起こりやすい錯体を
説明しておきます。
それはズバリ!
・遷移金属の八面体形錯体
・銅(II)錯体
が起こりやすくなる条件だ!
これをテトラアンミン銅(II)イオンに適用すると、
・本当は6配位になる
・銅(II)イオンが中心原子
と、見事条件に一致してる!
だからこそ、テトラアンミン銅(II)イオンは
✓ヤーンテラー効果を起こしたがって
✓正方形形になることで
✓エネルギー的に安定になるんだ!

正直、大学入試で問われない題材だけど
覚えておいて損はないし、
落単のリスクを少しでも回避できるなら
頭に留めておく程度に知っておくべき!
本日はここまで!
次回はテトラヒドロキシアルミン(III)酸イオン
の理由について説明するよ。
一読ありがとうございました!